Antes de Rutherford, el modelo atómico se conocía como modelo de Thomson, en el que la estructura del átomo era una esfera de carga positiva que albergaba electrones más pequeños con carga negativa en su interior, como ciruelas dentro de un pudín. En 1911, Rutherford y sus compañeros Hans Geiger y Ernest Marsden iniciaron una serie de experimentos innovadores que cambiarían por completo el modelo aceptado del átomo. Este experimento demostró la existencia de un núcleo en el átomo y cambia la comprensión de la estructura atómica.
Rutherford insistió en un modelo con una alta carga concentrada en el medio del átomo, que además contenía la masa del átomo-núcleo (Modelo de Órbita Planetaria). Probó la validez del modelo atómico de Thomson realizando el siguiente experimento:
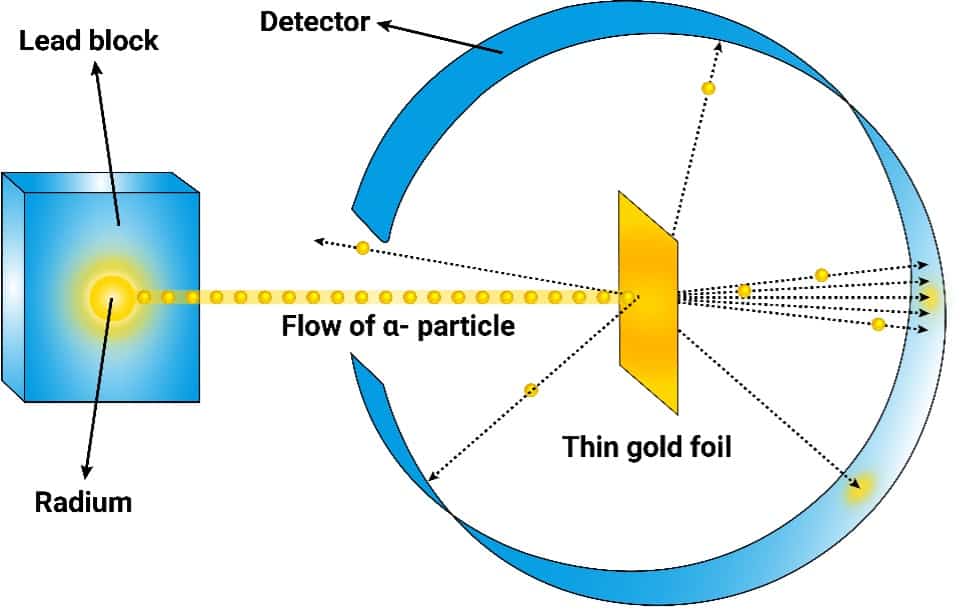
1.Preparó la configuración experimental de la Figura 1 que consiste en una fuente de partículas α; (He2+ cargado positivamente), una fina lámina de oro (0,6 μm) y un detector de ZnS.
2.Bombardeó la lámina de oro. Si el modelo de Thomson fuera correcto, se esperaría que las partículas α estuvieran presentes. tener suficiente espacio libre para penetrar la lámina y golpear el detector sin obstáculos.
3.Sin embargo, observó que algunas partículas α estaban cambiando de ángulo.
4.Luego, concluyó que había puntos en la lámina de oro donde se concentraba masa positiva (núcleo atómico). Se suponía que alrededor de este núcleo se movían electrones cargados negativamente.
En resumen, para el experimento de Rutherford se cumple lo siguiente:
- La carga positiva se concentra en el núcleo del átomo.
- La masa del átomo es casi igual a la masa del núcleo.
- Los electrones cargados negativamente se mueven alrededor del núcleo.
- Los electrones son de tamaño muy pequeño en comparación con el núcleo, están distribuidos alrededor del núcleo y ocupan la mayor parte del volumen del átomo.
- El los átomos tienen carga neutra porque el núcleo con carga positiva y los electrones con carga negativa se compensan entre sí.

El modelo de Rutherford resultó ser un paso importante hacia una comprensión completa del átomo. Sin embargo, no aclaró completamente la naturaleza de los electrones y cómo ocupaban el enorme espacio que rodea el núcleo. Sólo unos años más tarde fue posible comprender plenamente el electrón. Según los resultados del experimento resultó ser la clave para comprender las propiedades químicas de los elementos.
A través de VRLab Academy, los estudiantes pueden tener experiencia práctica con un laboratorio virtual en VRLab Academy que muestra los modelos atómicos . Pueden aprender mucho como lo hizo Ernest Rutherford, utilizando principios científicos en una simulación en línea. Pueden hacer el mismo experimento varias veces o probar diferentes versiones. De esta manera obtendrás nuevas experiencias y adquirirás nuevos conocimientos. ¡Este es un experimento que cambia el mundo para los estudiantes!
Eche un vistazo a todos los experimentos en VRLab Academy ymejora tu poder de enseñanza con nosotros.
Referencias
https://www.radioactivity.eu.com/site/pages/Rutherford_Experiment.htm
https://www.nobelprize.org/prizes/chemistry/1908/rutherford/biographical/